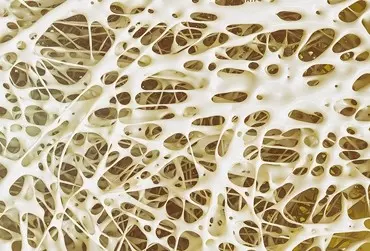
Osteoporoza to choroba układu kostnego charakteryzująca się zmniejszeniem gęstości mineralnej kości i zaburzeniem jej mikrostruktury. Według Światowej Organizacji Zdrowia może prowadzić do zwiększonego ryzyka złamań i być przyczyną poważnych dysfunkcji narządu ruchu oraz prowadzić do kalectwa, a nawet śmierci. Rozpoznanie potwierdza wskaźnik T-score ≤ –2,5 wyznaczony w trakcie badania gęstości mineralnej kości w kręgosłupie lędźwiowym, szyjce kości udowej lub w stawie biodrowym jako całości [1]. Nazywana jest „cichą epidemią” [2] i stanowi poważny problem medyczny, społeczny i ekonomiczny. W 2000 r. liczba złamań osteoporotycznych na świecie wynosiła 9 mln [2]. W tym samym roku zdiagnozowano na świecie 1,6 mln złamań bliższego końca kości udowej (BKKU), przy czym szacuje się, że w 2050 r. liczba ta wzrośnie do 6,26 mln [2]. W Europie średnio co 30 sekund notowane jest złamanie na tle osteoporozy, a ich liczba w 2000 r. wynosiła ponad 3 mln [2]. W 2009 r. w Polsce odnotowano ponad 167 tys. złamań niskoenergetycznych [2]. Ryzyko życiowe złamania osteoporotycznego wynosi u 50-letnich kobiet 40%, natomiast u mężczyzn w tym wieku 13% [2].
REKLAMA
Do najczęstszych skutków osteoporozy należą złamania BKKU, złamania części dalszej kości promieniowej oraz złamania kręgosłupa. Złamania BKKU są obarczone dużym ryzykiem powikłań ogólnoustrojowych, których efektem jest zgon co piątej kobiety i co czwartego mężczyzny w perspektywie roku [2]. Nazywane są „ostatnim złamaniem w życiu”. Niskoenergetyczne złamania części dalszej kości promieniowej (złamania loco typico) często niosą ze sobą komplikacje. W ok. 40% przypadków łączą się z przewlekłymi zespołami bólowymi, nieprawidłowym zrostem i zespołem algodystroficznym (Sudecka) [2]. Osteoporotyczne złamania kręgosłupa dotyczą ok. 25% kobiet po 50. roku życia i 50% kobiet po 85. roku życia. Mimo że w 70% przypadków są bezobjawowe, to często powodują zmiany anatomiczne kręgów i deformacje posturalne, co może być przyczyną dysfunkcji układu krążeniowo-oddechowego i pokarmowego. Przekłada się to na zwiększenie pięcioletniej śmiertelności o 15–20% [2].
Ogromny problem stanowią także koszty leczenia osteoporozy. Na podstawie danych Narodowego Funduszu Zdrowia z 2011 r. koszty leczenia złamań osteoporotycznych w pierwszym roku leczenia wynosiły w Polsce ponad 1 mld 776 mln złotych [2]. Przy tym całkowity koszt leczenia tych pacjentów, z uwzględnieniem długotrwałego inwalidztwa i profilaktyki, wynosił już ponad 2 mld 966 mln złotych [2].
Diagnostyka osteoporozy
Diagnostyka osteoporozy opiera się głównie na badaniu gęstości mineralnej kości (densytometria, dual energy X-ray absorptiometry – DXA). Zgodnie z wytycznymi WHO powinno być ono wykonywane w szyjce kości udowej i kręgosłupie [2]. Na rozpoznanie osteoporozy (ICD-9, 733.0) pozwala wartość T-score < –2,5 SD (standard deviation). T-score w przedziale –1 do –2,5 umożliwia rozpoznanie osteopenii. T-score > –1 jest wartością prawidłową. Dotyczy to kobiet po menopauzie i mężczyzn powyżej 50. roku życia [3]. U kobiet przed menopauzą, mężczyzn przed 50. rokiem życia, młodzieży przed 20. rokiem życia i dzieci stosuje się wskaźnik Z-score. Wartość ≤ –2,0 SD określa się jako „obniżoną gęstość mineralną kości w stosunku do oczekiwanej dla płci i wieku” [3]. U dzieci do piątego roku życia wskazane jest oznaczanie składników mineralnych kości (bone mineral content – BMC) oraz gęstości mineralnej kości (bone mineral density – BMD) [3].
W trakcie diagnostyki niezwykle istotne jest określenie etiologii schorzenia. Różnicuje się osteoporozę pierwotną i wtórną. Badanie laboratoryjne powinno zawierać morfologię krwi, OB, określenie stężeń wapnia, fosforu, ALP, kreatyniny i witaminy D. Badanie moczu powinno zawierać badanie ogólne, oznaczenie poziomu wapnia, fosforu i kreatyniny.
Złamania nieskoenergetyczne są poważnym następstwem osteoporozy. Ryzyko ich wystąpienia rośnie wraz ze spadkiem gęstości mineralnej kości. Należy jednak podkreślić, że większość złamań osteoporotycznych (ok. 75%) nie spełnia kryteriów diagnostycznych DEXA T-score –2,5 [2]. Dlatego opracowano, jako metodę pomocniczą, algorytm FRAX służący do obliczenia ryzyka złamania osteoporotycznego z pominięciem badania densytometrycznego na podstawie czynników ryzyka (przebyte złamanie, złamanie BKKU u rodziców, palenie przez rodziców, stosowanie glikokortykosteroidów, reumatoidalne zapalenie stawów, osteoporozy wtórne, alkoholizm) [2, 3].
Leczenie osteoporozy
Następstwa osteoporozy zmniejszają komfort życia pacjentów, dlatego niezmiernie ważna jest jej wczesna diagnostyka i profilaktyka. Leczenie, którego celem jest uniknięcie złamania, przebiega w kilku kierunkach. Podstawą jest suplementacja wapnem i witaminą D oraz zdrowy tryb życia i zapobieganie upadkom. W ostatnich latach nieodłącznym elementem terapii stały się leki aktywne w osteoporozie.
W wielu rejonach świata, w tym również w Polsce, powszechne są niedobory wapnia wśród ludności. Dzienne zapotrzebowanie na ten pierwiastek u osoby dorosłej wynosi 800–1200 mg. Dawkę taką można uzyskać w wyniku prawidłowej diety, lecz duża część populacji jej nie osiąga. Wskazana jest więc suplementacja. Należy jednak pamiętać, że przekroczenie dawki 1200 mg/dobę jest zagrożone wystąpieniem powikłań ze strony układu sercowo-naczyniowego, kamicą nerkową, a także udarem mózgu [17]. Analogiczna sytuacja ma miejsce w przypadku witaminy D. Suplementacja, szczególnie w okresie zimowym, jest wskazana – zgodnie z najnowszymi rekomendacjami w dawce 2000 j.m. [2]. Witamina D, jest niezbędna do prawidłowego wchłaniania wapnia w przewodzie pokarmowym. Odpowiedni poziom zarówno wapnia, jak i witaminy D zmniejsza ryzyko wystąpienia osteoporozy i złamań [16].
Następstwa osteoporozy zmniejszają komfort życia pacjentów, dlatego niezmiernie ważna jest jej wczesna diagnostyka i profilaktyka.
Leki modyfikujące w leczeniu osteoporozy to bisfosfoniany, denosumab, ranelinian strontu, parathormon oraz wybiórcze modulatory receptorów estrogenowych (SERM) [2].
Bisfosfoniany hamujące resorpcję kości zależną od osteoklastów są jednym z głównych leków modyfikujących używanych w leczeniu osteoporozy. Zmniejszają ryzyko złamania szyjki kości udowej o ok. 40%,
a kręgosłupa o 60% [2]. Są trudno wchłanialne z przewodu pokarmowego. Z tego powodu powinny być przyjmowane na czczo i popijane szklanką wody. Po ich zażyciu nie należy kłaść się przez pół godziny. W zależności od preparatu przyjmowane mogą być co tydzień (alendronian w dawce 70 mg, ryzedronian w dawce 35 mg), co miesiąc (ibandronian p.o. w dawce 150 mg), raz na kwartał (ibandronian i.v. w dawce 3 mg)
i raz do roku (zolendronian 5 mg). Możliwe jest ich stosowanie w profilaktyce osteoporozy, przy rozpoznaniu osteopenii [3]. Dzielą się na leki pierwszego (alendronian, ryzedronian, zolendronian) i drugiego rzutu (ibandronian). Należy podkreślić, że ibandronian nie ma rejestracji w grupie mężczyzn [3]. Czas leczenia bisfosfonianami nie jest jednoznacznie określony. U pacjentów z zaawansowaną osteoporozą i dużym ryzykiem złamania zaleca się, by maksymalny okres terapii nie przekraczał 10 lat. U pacjentów z umiarkowanym ryzykiem złamania czas terapii nie powinien być dłuższy niż pięć lat [3].
Denosumab będący lekiem nowej generacji w leczeniu osteoporozy jest ludzkim przeciwciałem monoklonalnym klasy IgG2 skierowanym przeciwko ligandowi RANK (receptor activator of nuclear factor κB). Hamuje resorpcję kości przez zahamowanie tworzenia i funkcji osteoklastów. Jest wysoce swoisty, a jego aktywność ograniczona do układu kostnego. Spadek markerów obrotu kostnego o 85% jest zauważalny już po trzech dobach od podania [3]. Denosumab wpływa na BMD całego układu kostnego [3]. Zmniejsza ryzyko złamań w obrębie szkieletu osiowego i poza nim [4]. W przeciwieństwie do innych leków przeciwosteoporotycznych nie generuje skutków ubocznych dla przewodu pokarmowego i może być stosowany u ludzi starszych i z niewydolnością nerek [5]. Zmniejsza ryzyko złamania BKKU o 40%, a kręgosłupa o 68% [2]. Podaje się go podskórnie co sześć miesięcy w dawce 60 mg. Zarejestrowany jest w terapii mężczyzn i kobiet w okresie pomenopauzalnym [3].
Ranelinian strontu obecnie stosuje się rzadko ze względu na duży odsetek powikłań u osób w podeszłym wieku. Ma działanie antyresorpcyjne i kościotwórcze, ale mechanizm działania u człowieka nie jest wyjaśniony [6]. W Europie zarejestrowany jest przez Europejską Agencję Leków (European Medicines Agency – EMA) w terapii osteoporozy pomenopauzalnej u kobiet i w terapii u mężczyzn. Ma udowodnione działanie przeciwzłamaniowe w typowych lokalizacjach [7, 8].
Podawany jest doustnie, na czczo, w dawce 1 g co 12 godzin. Istnieją liczne przeciwwskazania do jego stosowania [9].
Analog parathormonu jest obecnie najskuteczniejszym lekiem w terapii zaawansowanej osteoporozy [2, 10].
Teryparatyd (rhPTH1-34, rekombinowany N-końcowy fragment ludzkiego parathormonu) redukuje ryzyko złamań osteoporotycznych średnio o 65% [2, 3, 10]. Stosowany jest podskórnie w dawce 20 μg raz dziennie [3, 10]. Nie może być jednak podawany dłużej niż dwa lata [2, 3, 10]. Zmniejsza ryzyko złamań zarówno kręgowych, jak i pozakręgowych, z wyjątkiem kości promieniowej [10, 11]. Istnieją dość liczne przeciwwskazania do stosowania analogów parathormonu [3].
Wybiórcze modulatory receptorów estrogenowych (SERM) – ich głównymi przedstawicielami są raloksyfen i bazedoksyfen [3]. Zmniejszają ryzyko złamań szkieletu osiowego, u chorych z wcześniejszym złamaniem o 30%, bez wcześniejszego złamania o 55%. Nie wykazano wpływu na ryzyko złamania BKKU [2, 12, 13]. Leki te zmniejszają ryzyko rozwoju nowotworów piersi i pozytywnie wpływają na układ sercowo-naczyniowy [2, 14, 15], ale jednocześnie zwiększają ryzyko choroby zakrzepowo-zatorowej [13].
Przyczyny złamań osteoporotycznych
Jedną z najczęstszych bezpośrednich przyczyn złamań osteoporotycznych są upadki. Przyczyniają się przynajmniej do 90% złamań loco typico i BKKU. Ich liczba rośnie statystycznie u osób dorosłych wraz z wiekiem: 40% osób zdrowych po 60. roku życia upada raz w roku, ale już po 80. roku życia raz w roku upada 50% osób. Złamaniem kończy się 5% upadków. Upadki i złamania, jako ich konsekwencje, są piątą co do częstości przyczyną zgonu u pacjentów po 75. roku życia. Ryzyko złamania osteoporotycznego wzrasta, jeśli chory doznał wcześniej innego złamania.
U pacjentów po złamaniu BKKU ryzyko kolejnego złamania wzrasta sześciokrotnie [2].
Przyczyn upadków należy upatrywać zarówno w czynnikach zdrowotnych, jak i środowiskowych. Czynniki środowiskowe to szeroko pojęte przeszkody architektoniczne, braki środków bezpieczeństwa (np. uchwytów w łazience, poręczy itp.) i oświetlenia. Czynniki zdrowotne to przede wszystkim postępujące wraz z wiekiem deficyty narządu wzroku i ruchu, zmiany zwyrodnieniowe czy zaburzenia układu neurologicznego i sercowo-naczyniowego.
Jedną z najczęstszych bezpośrednich przyczyn złamań osteoporotycznych są upadki. Przyczyniają się przynajmniej do 90% złamań loco typico i BKKU.
Podsumowanie
Osteoporoza jest na świecie dużym problemem. W Polsce dodatkowo brak powszechnie dostępnych programów zapobiegania upadkom osób starszych oraz odpowiedniego dostępu do lekowych programów leczenia i profilaktyki osteoporozy stanowi przyczynę „epidemii” osteoporozy [2]. Należy podkreślić, że jedynie 3,7% pacjentów cierpiących na osteoporozę w Polsce jest leczonych [2]. Z uwagi na znaczne społeczne i finansowe koszty leczenia następstw osteoporozy i towarzyszących jej złamań aktywna, systemowa profilaktyka jest niezbędna.
Piśmiennictwo
- NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis, and Therapy. JAMA 2001; 285 (6): 785–795.
- Czerwiński E., Synder M. Raport osteoporoza – cicha epidemia w Polsce. Europejska Fundacja Osteoporozy i Chorób Mięśniowo-Szkieletowych, Polskie Towarzystwo Ortopedyczne i Traumatologiczne. Kraków 10.02.2015.
- Leszczyński P., Korkosz M., Pawlak-Buś K. i wsp. Diagnostyka i leczenie osteoporozy – zalecenia Polskiego Towarzystwa Reumatologicznego 2015. Forum Reumatol 2015; 1 (1): 12–24.
- McCloskey E.V., Johansson H., Oden A. i wsp. Denosumab reduces the risk of osteoporotic fractures in postmenopausal women, particularly in those with moderate to high fracture risk as assessed with FRAX. J Bone Miner Res 2012; 27: 1480–1486.
- Jamal S.A., Ljunggren O., Stehman-Breen C. i wsp. Effects of denosumab on fracture and bone mineral density by level of kidney function. J Bone Miner Res 2011; 26: 1829–1835.
- Reginster J.Y., Deroisy R., Jupsin I. Strontium ranelate: a new paradigm in the treatment of osteoporosis. Drugs Today (Barc) 2003; 39: 89–101.
- Cianferotti L., D’Asta F, Brandi M.L. A review on strontium ranelate long-term antifracture efficacy in the treatment of postmenopausal osteoporosis. Ther Adv Musculoskelet Dis 2013; 5: 127–139.
- Reginster J.Y., Seeman E., De Vernejoul M.C. i wsp. Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: Treatment of Peripheral Osteoporosis (TROPOS) study. J Clin Endocrinol Metab 2005; 90: 2816–2822.
- //www.ema.europa.eu
- Eriksen E.F. Treatment of osteopenia. Rev Endocr Metab Disord. 2012; 13: 209–223.
- Neer R.M., Arnaud C.D., Zanchetta J.R. i wsp. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001; 344: 1434–1441.
- Ettinger B., Black D.M., Mitlak B.H. i wsp. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: results from a 3-year randomized clinical trial. Multiple Outcomes of Raloxifene Evaluation (MORE) Investigators. JAMA 1999; 282: 637–645.
- Siris E.S., Harris S.T., Eastell R. i wsp. Skeletal effects of raloxifene after 8 years: results from the continuing outcomes relevant to Evista (CORE) study. J. Bone Miner Res 2005; 20: 1514–1524.
- Cummings S.R., Eckert S., Krueger K.A. i wsp. The effect of raloxifene on risk of breast cancer in postmenopausal women: results from the MORE randomized trial. Multiple Outcomes of Raloxifene Evaluation. JAMA 1999; 281: 2189–2197.
- Vogel V.G., Costantino J.P., Wickerham D.L. i wsp. Effects of tamoxifen vs raloxifene on the risk of developing invasive breast cancer and other disease outcomes: the NSABP Study of Tamoxifen and Raloxifene (STAR) P-2 trial. JAMA 2006; 295: 2727–2741.
- Rizzoli R. Nutrition: its role in bone health. Best Pract Res Clin Endocrinol Metab 2008; 22: 813–829.
- National Osteoporosis Foundation. Clinician’s Guide to Prevention and Treatment of Osteoporosis. Washington, DC: National Osteoporosis Foundation, 2014.